BASES FISIOLÓGICAS Y MECANISMOS DE ACCIÓN DE
LA CIRUGÍA BARIÁTRICA Y METABÓLICA
José L. Tapia-González1, Fernando Y Valero F.2, Salvador A. Navarrete A.3, Luis Level 4, Dayana Medina2
1. Cirujano General. Adjunto servicio de cirugía
Hospital Dr. Luis Razetti. Barinas-Venezuela. Correo- e:
jltapia73@gmail.com
2. Cirujano General Unidad Quirúrgica del Centro. Barinas- Venezuela
3. Cirujano General Clínica Santa Sofía.Caracas-Venezuela
4. Cirujano General director del postgrado
de cirugía general UCV del Hospital Miguel Pérez
Carreño. Caracas- Venezuela
RESUMEN
En la actualidad la cirugía bariátrica y
metabólica es considerada una estrategia terapéutica con
indicación formal en el manejo de la obesidad y sus
comorbilidades, ya que actúa sobre el organismo no solo en
términos de pérdida de peso, también impacta
positivamente en el perfil metabólico del individuo, fomentando
cambios que influyen directamente sobre múltiples órganos
y sistemas, es por esto que el estigma de ser una cirugía para
la obesidad se ha derrumbado de forma estrepitosa ante la evidencia
científica que avala un cambio metabólico positivo
incluso en pacientes con grados bajos de obesidad, sobrepeso y no
obesos. Esto ha generado una nueva vertiente hacia el nombre de
cirugía metabólica para englobar todos estos efectos y no
encasillarla en el contexto solo de los obesos. Esta publicación
pretende hacer un resumen breve pero bien fundamentado de los
principales mecanismos de acción inducidos por estas
técnicas.
Palabras clave: Cirugía bariátrica y metabólica, bases, mecanismos
Physiological bases and mechanisms of action of bariatric and metabolic surgery
ABSTRACT
Currently, bariatric and metabolic surgery is considered a therapeutic
strategy with formal indication in the management of obesity and its
comorbidities, since it acts on the body not only in terms of weight
loss, it also positively impacts the metabolic profile of the
individual. , promoting changes that directly influence multiple organs
and systems, which is why the stigma of being a surgery for obesity has
collapsed resoundingly in the face of scientific evidence that supports
a positive metabolic change even in patients with low degrees of
obesity, overweight and not obese. This has generated a new trend
towards the name metabolic surgery to encompass all these effects and
not pigeonhole it in the context of only the obese. This publication
aims to provide a brief but well-founded summary of the main mechanisms
of action induced by these techniques.
Key words: Bariatric and metabolic surgery, bases, mechanisms
INTRODUCCIÓN
La denominada cirugía bariátrica y metabólica
(CBM) ¨moderna¨, tiene sus origines en el año 1954,
cuando Jhon Linner, Richard L. Varco y Owen H. Wangenteen, practicaron
en un modelo canino un bypass yeyuno-ileal, procedimiento presentado en
el American Surgical Spring Meeting de ese año.(1) Generando las
bases y abriendo un campo quirúrgico desconocido que
inspiró a otros cirujanos a perfeccionar las técnicas y
desarrollar nuevas, hasta la actualidad con las que hoy conocemos.
Consiste en una serie de procedimientos quirúrgicos que
actúan restringiendo la capacidad gástrica y evitando el
paso de los alimentos por el duodeno y parte del yeyuno, produciendo
malabsorción de los mismo debido a diversas alteraciones
fisiológicas de los péptidos incretinas, los
ácidos biliares y del sistema autónomo; cuyo objetivo
principal es generar pérdidas significativas de peso a corto y
largo plazo.(2) Sin embargo, es pertinente preguntarnos ¿Este es
el único efecto de estas cirugías? El desarrollo continuo
de la especialidad, la investigación, el seguimiento y los
avances tecnológicos entre otras cosas, han logrado dar una
respuesta clara a esto, poniendo en evidencia múltiples
beneficios de índole metabólico que incrementa la calidad
y la expectativa de vida.
Clásicamente los principios de la CBM están fundamentados
en la restricción y la mala absorción. En relación
con la primera, podemos afirmar que se crea una disminución
física del tamaño gástrico, limitando la cantidad
de alimentos que se pueden consumir, lo cual se traduce en una
importante reducción calórica. En la mala
absorción se altera el sistema digestivo de manera que los
alimentos pasan por alto parte del intestino delgado, donde se absorben
nutrientes, disminuyendo la absorción de los mismos y las
calorías, contribuyendo a la pérdida de peso. Ahora bien,
existen técnicas mayormente restrictivas como la
gastrectomía vertical que también tiene acción
metabólica elevando el GLP1 y aquellas que combinan ambos
principios como el bypass gástrico. Acotando que la
restricción es común a todos los procedimientos.
La evidencia científica ha demostrado de forma amplia que la CBM
es la modalidad de tratamiento más efectiva para lograr
reducciones sostenidas de peso y reducciones demostrables en la
morbimortalidad.(3) La obesidad se ha transformado en una enfermedad
discapacitante, que no solo se refleja en la limitación
física evidente que estos pacientes puedan presentar, sino
también en el impacto metabólico que tiene sobre sus
organismos, quedando clara la relación directa con la diabetes
mellitus tipo 2 (DM2), cardiopatía isquémica,
hipertensión arterial y una serie de condiciones que reducen la
esperanza y calidad de vida. Además de los costos que generan en
forma individual y a los sistemas sanitarios. Es por lo que se pone en
primer plano el hecho de la mejoría indiscutible de estas
condiciones, gracias a los efectos positivos que vamos a describir
más adelante, todos derivados de los cambios anatómicos
que se realizan en la CBM.
Es muy importante entender que estos beneficios, no se limitan a
pacientes obesos mórbidos, también aquellos con
obesidades tipo I y II e incluso sin obesidad que son portadores de
patologías metabólicas de difícil control
médico. Cada vez hay más evidencia científica de
nivel 1 y 2 que respalda esto, tanto es así, que existe una
fuerte tendencia a dejar atrás el nombre de CBM y sustituirlo
por el de cirugía metabólica.
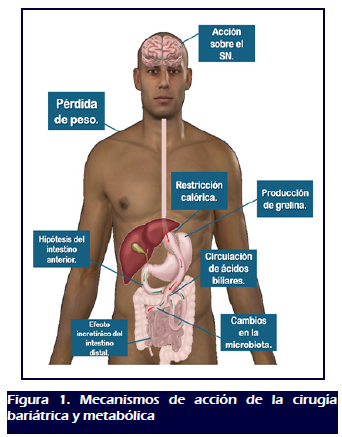
MECANISMOS DE ACCIÓN DE LA CIRUGÍA BARIÁTRICA Y METABÓLICA
Se han descrito varios mecanismos que tienen un impacto directo o
indirecto sobre la pérdida de peso y el control de las
morbilidades asociadas, entre ellos podemos mencionar (Figura 1).
1. Restricción dietética: se logra
fundamentalmente mediante la reducción del volumen
gástrico, lo que limita la ingesta alimentaria y provoca
saciedad precoz.4 Restringiendo el aporte calórico,(2) lo cual
se traduce en pérdida de peso. Desde el punto de vista
metabólico, induce control de la glucemia sin ningún
efecto enterohormonal conocido, revirtiendo la resistencia
periférica a la insulina hepática sin una significativa
pérdida de peso. Este efecto puede obtenerse igualmente sin
cirugía y de hecho es uno de los pilares del tratamiento
médico de la DM2 asociada a la obesidad, y la base racional de
la preparación preoperatoria de la obesidad mórbida
mediante dieta estricta.(5,6) Con pérdidas de un 20% del peso
mejora la resistencia periférica a la insulina muscular, o
sólo del 10% si se asocia a malabsorción lipídica.
A medio plazo (dos años) la pérdida por sí sola no
es suficiente para el control de la DM2.(5,7)
2. Hipótesis del intestino anterior: surge de los
cambios derivados de la modificación anatómica donde se
excluye el paso de alimentos por el duodeno y el yeyuno proximal. El
impacto en la pérdida de peso se justifica por la
disminución de la absorción intestinal secundaria a este
procedimiento. La mejoría metabólica que se atribuye a
este mecanismo, sugiere un papel del intestino proximal en el control
de la homeostasis de la glucosa.(5) Estudios en modelos animales,
primero con exclusión y después con reconstrucción
del paso duodenal de alimentos, parecen justificar la existencia de un
factor antincretínico segregado en la primera parte del
intestino,(5,8) el cual es identificado como una fracción
proteica de 10 a 100 kDa que actuaría impidiendo la
liberación de insulina en respuesta a la entrada de glucosa en
el duodeno.(9)
3. Efecto incretínico del intestino distal: Las
células L (productoras de GLP-1 y PYY) son
enteroendócrinas con la función de producir y generar
varios polipéptidos, se encuentran en el sistema
gastrointestinal predominantemente en el íleon y el
colon.(10,11) Posterior a la modificación anatómica
propia de las cirugías bariátricas y metabólicas,
la llegada más rápida de alimentos y nutrientes al
intestino distal, produce activación de las mismas, la mucosa
secretora del íleon terminal se estimula en forma excesiva por
la presencia de alimentos digeridos de forma incompleta. Es decir, los
alimentos llegan precozmente a los segmentos distales del intestino, lo
que genera una fuerte estimulación de las células L, con
producción de péptido similar al glucagón tipo 1
(GLP-1) y del polipéptido YY (PYY), que son anorexígenos
con efecto incretínico que enlentece el vaciamiento
gástrico y produce un aumento de la saciedad a nivel central.
(4,12,13) Los niveles en sangre de GLP-1 y PYY están
significativamente elevados tan temprano como a los dos días
después del bypass gástrico y permanecen así
más de una década(2) Estos péptidos,
principalmente el GLP-1, tienen acciones proliferativas y
anti-apoptóticas sobre las células beta
pancreáticas,5 aumentan la biosíntesis y
liberación de insulina, mejorando la captación de glucosa
y síntesis de glicógeno en el hígado y tejidos
periféricos, disminuye la síntesis de glucógeno
hepático y mejora la resistencia a la insulina al disminuir la
liberación de glucagón por las células alfa
pancreáticas. (4,14,15) Merece la pena mencionar que este efecto
incretínico es la base del desarrollo de fármacos como
agonistas del receptor GLP-1 y los inhibidores de la Dipeptidil
Peptidasa IV, (5,16) los cuales son utilizados como tratamiento
médico de la diabetes mellitus tipo 2.
4. Cambios en la microbiota: La microbiota intestinal es
la población microbiana que vive en el intestino de manera
comensal y mutualística con el hospedero. Está compuesta
por bacterias, arqueas, hongos y virus. El microbioma es el
número total de microorganismo y su material genético, en
términos de cantidad, composición, metabolitos que
producen y funciones que ejercen. Las acciones centrales de la
microbiota intestinal saludable incluyen la biodegradación de
polisacáridos, la producción de ácidos grasos de
cadena corta, el enriquecimiento de lipopolisacáridos
específicos y la producción de vitaminas y
aminoácidos esenciales. En el paciente obeso existe disbiosis,
término que implica la incapacidad de individuo de retornar a
una microbiota saludable. Lo cual se relaciona con la
inflamación sistémica derivada del aumento de peso,
particularmente por lipotoxicidad, condicionando resistencia a la
insulina e incluso síndrome metabólico y esteatosis
hepática de origen no alcohólico.(17) Posterior a la
cirugía, la microbiota sufre modificaciones importantes,
permitiendo que ocurran aumentos y disminuciones en la abundancia de
algunos grupos de bacterias, conformando una nueva comunidad que
produce metabolitos que interactúan con el individuo mejorando
su perfil metabólico, principalmente el de los carbohidratos y
lípidos, lo cual se refleja en el control glicémico y del
peso. Este efecto directo sobre el microbioma posterior a la
cirugía tiene un origen multifactorial condicionado por la
modificación anatómica, que incluye: restricción
dietética, modificación de los ácidos biliares,
cambios de pH y niveles de oxígeno en la luz intestinal,
disminución de la superficie de absorción nutricional y
la llegada precoz de alimentos digeridos de forma incompleta al yeyuno
proximal e íleon distal. Induciendo cambios en el accionar
bacteriano que modulan el metabolismo del huésped. Si bien, los
resultados son evidentemente positivos, en la actualidad la
mayoría de los estudios son a corto plazo y de series
pequeñas de pacientes. Sin embargo, trabajos como el de
Magouliotis y col,(18) afirman: ¨la microbiota intestinal post
operatoria de sujetos con obesidad mórbida fue similar a la de
sujetos con sobrepeso o con obesidad leve, con aumento de GLP-1, GLP-2,
PYY y TMAO y disminución de BCCA (aminoácidos ramificados
esenciales), que en su conjunto dieron como resultado la
disminución de glucosa, insulina, triglicéridos,
colesterol total, LDL, HOMA IR, disminución del apetito, y
remisión de diabetes mellitus¨.
5. Ácidos biliares: Los cambios anatómicos
de las cirugías derivativas, hacen que la bilis progrese al
intestino distal, sin estar mezclada con el bolo alimentario en su
totalidad, mejorando la disponibilidad de ácidos biliares a
nivel del intestino distal, lo que produce la activación del
receptor TGR5 (receptor acoplado a proteína G específico
para ácidos biliares) en las células L, produciendo un
incremento en la secreción de GLP-1 y PYY,2,(19) favoreciendo el
efecto incretínico. También se unen al receptor
farnesoide X (FXR), que provoca la liberación del factor de
crecimiento fibroblástico 19 con efecto insuline-like induciendo
la producción de glucógeno e inhibiendo la
producción de insulina.5,20 El FXR está ubicado a nivel
nuclear, por lo que para su activación es necesaria la entrada a
la célula de los ácidos biliares, a diferencia del TGR5
que se encuentra en la membrana por lo que no es necesario que el
ácido biliar entre a la célula, siendo el simple paso de
estos por el tubo digestivo el que lo activa.(21) Existe una
relación directa entre los ácidos biliares y la
microbiota intestinal, ya que estos tienen propiedades antimicrobianas
que reducen el tamaño de subpoblaciones bacterianas, con el
consecuente impacto directo en el microbioma.(22) Las bacterias los
usan como sustratos de biotransformación en el colon,
estableciéndose una real comunicación entre ellos,
generando en el huésped efectos metabólicos positivos a
través de los receptores FXR y TGR5.(17) En conclusión,
las modificaciones secundarias a la cirugía bariátrica y
metabólica, tienen un impacto directo sobre el pool de
ácidos biliares del individuo y la microbiota, que sumado a la
mencionada interacción entre estos dos elementos, modifica de
manera positiva en el perfil metabólico.
6. Acción sobre el sistema nervioso (SN): Las
fibras vagales de la mucosa gástrica son sensibles al
estiramiento mecánico para detectar el volumen de los alimentos
ingeridos, en cirugías como el bypass gástrico se
preservan las fibras terminales a nivel del reservorio y podrían
mediar la saciedad al paso de los alimentos por este. La
denervación vagal más distal puede alterar la
señalización lo que puede influir en la saciedad. La
información sensorial visceral del intestino se comunica
centralmente mediante la señalización del nervio vago
aferente (sensorial) al núcleo del tracto solitario.
Aquí, la información sensorial visceral y los aportes
hormonales y metabólicos se integran junto con los aportes
neuronales de otras áreas del tronco encefálico y bien
pueden ser la forma más importante en que estas cirugías
envía señales al cerebro.(2,23) El sistema nervioso es
otro regulador clave de los procesos metabólicos. Tanto el
sistema nervioso simpático como el parasimpático
controlan el metabolismo de la glucosa directamente a través de
la entrada neuronal e indirectamente a través de la
circulación para influir en la liberación de insulina,
glucagón y la producción hepática de glucosa.(16)
La liberación de hormonas como el GLP-1, ghrelina,
péptido YY, o la leptina cuya secreción se modifica en el
bypass gástrico, contribuyen a nivel del sistema nervioso
central a regular tanto la ingesta como la homeostasis de la glucosa
mediados por los sistemas simpático y parasimpático desde
el hipotálamo.(5) Esta región del cerebro también
regula la producción de glucosa hepática mediante la
acción de la insulina, la glucosa y los ácidos grasos. La
acción de la insulina en este sitio también es vital para
regular el peso corporal, con un efecto disminuido que conduce a la
obesidad. Más recientemente se ha demostrado que la
lesión neuronal inducida por inflamación se produce
rápidamente en roedores con una dieta rica en grasas y las
imágenes en humanos sugieren cambios estructurales en el
hipotálamo en consonancia con la gliosis en obesos en
comparación con individuos delgados.(16)
7. Pérdida de peso: El tejido adiposo visceral
presenta una alta tasa de lipolisis, liberando grandes cantidades de
ácidos grasos y citoquinas proinflamatorias hacia el
hígado y la circulación sistémica. Los
ácidos grasos libres producen resistencia a la insulina en los
tejidos efectores en un nivel post receptor y contribuyen a la
apoptosis de las células beta pancreáticas,
fenómeno conocido como lipotoxicidad. La pérdida de peso
y la disminución del tejido adiposo visceral, disminuye de forma
exponencial la lipotoxicidad y sus efectos nocivos para la homeostasis
metabólica. Este es posiblemente uno de los mecanismo más
importante para lograr control metabólico.(5)
8. Impacto sobre la producción de grelina: La
grelina es una hormona conocida por estimular el apetito. Existen
numerosas acciones posibles a través de las cuales ejerce su
efecto en el cuerpo: sobreproducción, reducción
después de las comidas y aumento de la sensibilidad del
receptor.(24) Posterior a la cirugía bariátrica,
particularmente la gastrectomía vertical, existe un descenso
importantísimo en la producción de esta, debido a la
eliminación del fundus gástrico (sitio de mayor
producción),(25) en cirugías como el bypass
gástrico los resultados son contradictorios.(24) Los principales
efectos que se le atribuyen a la grelina son: orexigénico,
interferir con la leptina en el sistema nervioso central, disminuir la
liberación de insulina en el páncreas, aumentar la
neoglucogénesis, favorecer la diferenciación de
preadipocitos en adipocitos, aumentar la glucogenólisis y
disminuir la lipólisis. Por lo tanto, su descenso se traduce en
un impacto metabólico positivo en el paciente y permite
sensación de mayor saciedad que se traduce en menor ingesta
alimentaria.(24-26) Aún hoy existen muchas interrogantes con
respecto a los mecanismos de acción que intervienen en la CBM,
no existiendo una explicación completamente certera y segura,
sin embargo, los avances alcanzados son promisorios y nos obligan a
seguir investigando.
Conflicto de Intereses
Los autores declaran no tener conflicto de interés alguno sobre el presente estudio.
REFERENCIAS
1. Chousleb E, Rodriguez JA, O’Leary P. History of the
Development of Metabolic/Bariatric Surgery. en The ASMBS Textbook of
Bariatric Surgery, 2a ed., Springer, pp. 37–46. Disponible en:
https://link.springer.com/book/10.1007/978-3-030-27021-6
2. Sogbe Miguel Eduardo, Di Frisco Isberling Madeleine,
Díaz Emilia. Cirugía bariátrica: Cambios
fisiológicos en el tratamiento del síndrome
metabólico. Gen 2016; 70(3): 93-99. Disponible en:
https://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0016-35032016000300007
3. David Pacheco Sánchez, Pilar Pinto Fuentes, Enrique
Asensio Díaz. Actualización en cirugía
bariátrica/metabólica. Nutr Clin Med 2019; XIII (2):
113-127. Disponible en:
https://nutricionclinicaenmedicina.com/wp-content/uploads/2022/05/5077.pdf
4. Hernández Rodríguez José, Arnold
Domínguez Yuri, Moncada Espinal Olga María.
Teorías y mecanismos que justifican el empleo de la
cirugía metabólica en personas con diabesidad. Rev Cubana
Endocrinol. 2018; 29( 3 ): 1-15. Disponible en:
http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1561-29532018000300008
5. Balongo García R, Bejarano Gómez-Serna D, De la
Rosa Báez A, Molina García D, García del Pino B,
Martínez Mojarro R, et al. Cirugía metabólica, un
nuevo paradigma para el tratamiento de la diabetes. Cir Andal.
2019;30(4):477-85. Disponible en:
https://www.asacirujanos.com/revista/2019/30/4/08
6. Isbell JM, Tamboli RA, Hansen EN, Saliba J, Dunn JP, Phillips
SE, et al. The importance of caloric restriction in the early
improvements in insulin sensitivity after Roux-en-Y gastric bypass
surgery. Diabetes Care 2010; 33: 1438-42. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2890335/
7. Pok EH, Lee WJ. Gastrointestinal metabolic surgery for the
treatment of type 2 diabetes mellitus. World J Gastroenterol. 2014; 20:
14315-28. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4202361/
8. Rubino F, Forgione A, Cummings DE, Vix M, Gnuli D, Mingrone
G, et al. The mechanism of diabetes control after gastrointestinal
bypass surgery reveals a role of the proximal small intestine in the
pathophysiology of type 2 diabetes. Ann Surg. 2006; 244: 741-9
Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1856597/
9. Salinari S, Mingrone G, Bertuzzi A, Previti E, Capristo E,
Rubino F. Down-regulation of Insulin Sensitivity After Oral Glucose
Administration: Evidence for the “Anti-Incretin Effect”.
Diabetes 2017; 66: 2756-63. Disponible en:
https://diabetesjournals.org/diabetes/article/66/11/2756/35210/Downregulation-of-Insulin-Sensitivity-After-Oral
10. El-Salhy M., Mazzawi T., Hausken T., Hatlebakk J.G.
Interaction between diet and gastrointestinal endocrine cell. Biomed
Rep. 2016; 4(6): 651-656. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4887949/
11. Liddle R.A. Neuropods. Cell Mol Gastroenterol Hepatol. 1019;
7(4): 739-747. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6463090/
12. Dixon J. Obesity and Diabetes: The Impact of Bariatric
Surgery on Type-2 Diabetes. World J Surg. 2009;33(10):2014-21.
Disponible en:
https://onlinelibrary.wiley.com/doi/epdf/10.1007/s00268-009-0062-y
13. Rubino F, Gagner M. Potential of Surgery for Curing Type 2
Diabetes Mellitus. Ann Surg. 2002;236(5):554-9. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1422611/
14. Papapietro K. Cirugía para la obesidad: efectos
generales, beneficios y riesgos. Revista Médica Clínica
Las Condes. 2012;23(2):189-95.37. Disponible en:
https://www.researchgate.net/publication/273093659_Cirugia_para_la_obesidad_efectos_generales_beneficios_y_riesgos
15. Raghow R. Bariatric surgery-mediated weight loss and its
metabolic consequences for type-2 diabetes. World J Diabetes.
2013;4(3):47-50. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3680623/
16. Kahn SE, Cooper ME, Del Prato S. Pathophysiology and
treatment of type 2 diabetes: perspectives on the past, present, and
future. Lancet. 2014; 383: 1068-83. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4226760/
17. Vigil-Guerrero RE, Gasco M, Gonzales GF. La cirugía
bariátrica modifica la diversidad bacteriana y los metabolitos
de la microbiota intestinal mejorando el perfil metabólico del
huésped y contribuyendo a la reducción del peso. Rev Soc
Peru Med Interna. 2021;34(4):162-172. Disponible en:
https://www.researchgate.net/publication/356985455_La_cirugia_bariatrica_modifica_la_diversidad_bacteriana_y_los_metabolitos_de_la_microbiota_intestinal_mejorando_el_perfil_metabolico_del_huesped_y_contribuyendo_a_la_reduccion_del_peso
18. Magouliotis DE, Tasiopoulou VS, Sioka E, Chatedaki C,
Zacharoulis D. Impact of Bariatric surgery on metabolic and gut
microbiota profile: A systematic review and meta- analysis. Obes Surg.
2017 May;27(5):1345-1357. Disponible en:
https://link.springer.com/article/10.1007/s11695-017-2595-8
19. Fujioka K. Follow-up of nutritional and metabolic problems
after bariatric surgery. Diabetes Care 2005; 28: 481-484. Disponible
en:
https://diabetesjournals.org/care/article/28/2/481/23978/Follow-up-of-Nutritional-and-Metabolic-Problems
20. Potthoff MJ, Kliewrw SA, Mangelsdorf DJ. Endocrine
fibroblast growth factors 15/19 and 21: from fesat to famine. Genes Dev
2012; 26: 312-24. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3289879/
21. Lefebvre P, Cariou B, Lien F, Kuipers F, Staels B. Role of
bile acids and bile acid receptors in metabolic regulation. Physiol
Rev. 2009 Jan;89(1):147-9. Disponible en:
https://journals.physiology.org/doi/full/10.1152/physrev.00010.2008?rfr_dat=cr_pub++0pubmed&url_ver=Z39.88-2003&rfr_id=ori%3Arid%3Acrossref.org
22. Islam S, Fukiya S, Hagio M, Fujii N, Ishizuka S, Ooka T, et
al. Bile acid is a host factor that regulates the composition of the
cecal microbiota in rats. Gastroenterology. 2011;141(5):1773-81.
Disponible en:
https://www.sciencedirect.com/science/article/abs/pii/S001650851101081X
23. Abdeen G, Le Roux CW. Mechanism Underlying the Weight Loss
and Complications of Roux-en-Y Gastric Bypass. Review. Obes Surg. 2016
Feb;26(2):410-21. Disponible en:
https://link.springer.com/article/10.1007/s11695-015-1945-7
24. Makris MC, Alexandrou A, Papatsoutsos EG, Malietzis G,
Tsilimigras DI, Guerron AD, et al. Ghrelin and Obesity: Identifying
Gaps and Dispelling Myths. A Reappraisal. In Vivo. 2017
Nov-Dec;31(6):1047-1050. Disponible en:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5756630/
25. Anderson B, Switzer NJ, Almamar A, Shi X, Birch DW, Karmali
S. The impact of laparoscopic sleeve gastrectomy on plasma ghrelin
levels: a systematic review. Obes Surg 23(9): 1476-1480, 2013.
Disponible en:
https://link.springer.com/article/10.1007/s11695-013-0999-7
26. Dimitriadis E, Daskalakis M, Kampa M, Peppe A, Papadakis JA,
Melissas J. Alterations in gut hormones after laparoscopic sleeve
gastrectomy: a prospective clinical and laboratory investigational
study. Ann Surg 257(4): 647-654, 2013. Disponible en:
https://journals.lww.com/annalsofsurgery/abstract/2013/04000/alterations_in_gut_hormones_after_laparoscopic.11.aspx